电话:17657166935
QQ:2301757537
地址:山东省青岛市城阳区上马街道河东路上马科技企业加速器202室
邮箱:longkesci@163.com
什么是免疫荧光实验?
免疫荧光通过抗体与示踪物质结合,利用抗原-抗体结合反应,进而对抗原所在的细胞或组织进行定性或定量。
免疫荧光的步骤比较简单,可同时标记多种蛋白,图片伪彩色观赏性强,但荧光容易淬灭,样品保存时间不长。
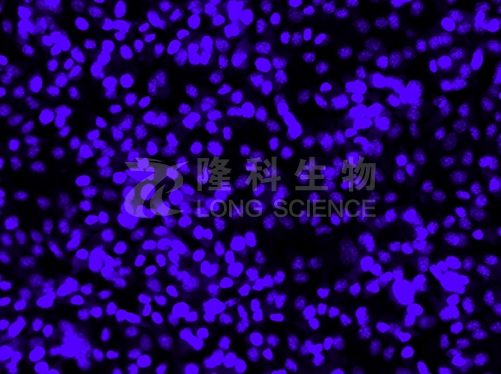
免疫荧光实验的原理:
由于荧光素所发的荧光可在荧光显微镜下检出,荧光素受激发光的照射而发出明亮的荧光,可以看见荧光所在的细胞或组织,利用定量技术测定含量,从而可对抗原进行细胞定性和定位分析。
免疫荧光实验可以快速直观的显示所检测蛋白的细胞定位。
样品:贴壁细胞;
试剂:4%组织固定液,PBS,Triton X-100,BSA,荧光二抗,免疫荧光染色二抗稀释液,抗荧光猝灭封片液,0.25%胰酶;
器材:6/12/24孔板,细胞爬片(盖玻片),载玻片,15ml离心管。
实验步骤:
实验前准备:配置 10% 封闭液;0.2% Triton X-100;
第一天:
1. 取普通洁净盖玻片于 75% 乙醇浸泡,无菌超净台内吹干,将玻片置于 6/12/24 孔板内,种入细胞培养液过夜,待细胞长至 30%~60% 满。
2. 按照特定的实验目的处理细胞后,吸尽培养液,用 2/1/0.5 ml PBS 洗两次,加入 1/0.5/0.25 ml 固定液,室温固定 15 min。
3. 去除固定液,用 PBS 润洗 3 次,每次 5 min,摇床轻摇。
4. 用 0.2% Triton X-100 室温通透 5 min,PBS 润洗 3 次,每次 5 min,摇床轻摇。
5. 用封闭液(2/1/0.5 ml/孔)封闭 60 min。
6. 吸去封闭液(勿洗),用一抗(1/0.5/0.25 ml/孔)作用 60 min 或 4 ℃ 过夜,摇床轻摇。
第二天:
7. 去除一抗,PBS 润洗 3 次,每次 5 min,摇床轻摇。
7. 弃 PBS,加入 1/0.5/0.25 ml/孔稀释的荧光二抗,室温避光孵育 40 min,摇床轻摇。
8. 回收荧光二抗,PBS 润洗 3 次,每次 5 min,摇床轻摇。
滴加 DAPI(200/100/50 μl/孔)避光孵育 5 min,PBS 润洗 4 次,每次 5 min,洗去多余的 DAPI。用滤纸吸干爬片上的液体,滴 1 滴抗荧光猝灭封片液于载玻片上,盖上贴有细胞的盖玻片,避免气泡,使细胞接触封片液,荧光显微镜观察绿色荧光。
注意事项
1、建议细胞直接种孔板,采用倒置荧光显微镜拍照,这样可以避免最后挑片时造成划片或细胞片破损以及最后封片可能造成滑片等结果;
2、若实验室只有正置荧光显微镜,则需要将细胞植于细胞爬片。
1)建议直接购买处理过的细胞爬片;
2)若只有普通细胞爬片,可以先将爬片于浓酸(浓酸腐蚀性强,注意操作)或 75% 乙醇浸泡过夜,若用酸浸泡过夜,第二天先用自来水小心冲洗掉爬片残留的酸液,若用 75% 乙醇浸泡,则不需要此步骤。
然后,用洗洁精搓洗爬片,最后用去离子水清洗爬片。置于烘箱 80 ℃ 烘干,再将爬片置于超净台造紫外消毒后备用;
3、根据所检测抗原所在位置来确认是否需要加入 Triton 进行通透。若所检测抗原表位位于膜蛋白的白外段,则不需要通透;
4、一般 5% BSA 封闭即可达到效果;
5、从加荧光二抗起,后面所有操作步骤尽量避光。
6、缩短在荧光显微镜下的观察时间,1~2 h 为宜。
7、染色后尽快荧光显微镜下观察,若不能可放入 4 ℃ 冰箱避光保存一周。
8、无/弱染色:烤片温度过高,推荐 56~60 ℃ 1~2 h;一抗是否适用固定液和石蜡切片,使用浓度是否过低,孵育是否时间过短等。
9、非特异性染色:是否灭活内源性过氧化物酶;孵育过程中干片;抗原热修复过度。
10、染色过深:一抗浓度过高;染色试浓度过高或孵育时间过长;染色剂浓度过高或孵育时间过长。
11、通常实验室先固定细胞再进行通透,但若检测抗原是水不溶性蛋白,可先通透再固定,这样可以通过通透去除一些水溶性蛋白,进而可降低免疫荧光背景和非特异性信号;
12、建议设阴性对照组,消除由于抗体非特异性结合而产生的背景染色;
13、选择醛类固定液时,保持其新鲜度,最好现配现用,使用不新鲜的醛类固定液自发荧光背景会升高。
1、信号弱或者无信号:
1)细胞或组织样本保存时间过长;2)抗体浓度不合适,参照抗体说明书的稀释浓度,再根据样本表达量进行摸索;3)一抗孵育时间不合适,建议 4 ℃ 过夜孵育。
2、高背景:
1)封闭不充分;2)抗体浓度过高;3)抗体孵育时间过长或温度过高;4)清洗不充分;5)样本变干,染色过程确保样品始终浸没于液体环境中
3、非特异性染色较多:
1)固定液残留,这里需要缩短固定时间并且在封闭液中加甘氨酸,并且抗原修复也可以帮助解决非特异性染色;
2)二抗残留,二抗需要用带有吐温 20 的 PBS 溶解,只要荧光显微镜的强度还可以增大,那么就可以增加吐温洗脱掉非特异性染色。